
01/03/2025 10:15
Tìm hiểu phản ứng ba+h2o trong hóa học
Phản ứng giữa Barium và Nước: Khám Phá Hóa Học Cơ Bản
Trong thế giới hóa học, nhiều phản ứng thú vị và kỳ diệu diễn ra hàng ngày. Một trong số đó là phản ứng giữa một kim loại kiềm thổ mạnh với nước, dẫn đến sự hình thành của hydroxide và khí hydro. Trong bài viết này, chúng ta sẽ đi sâu vào chi tiết của phản ứng này, từ cấu trúc hóa học cho đến ứng dụng thực tiễn của sản phẩm tạo thành.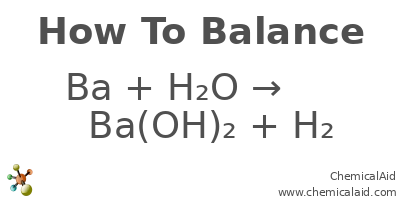
1. Giới Thiệu về Barium và Nước
1.1 Tính Chất Hóa Học của Barium
Barium, với ký hiệu hóa học Ba, là một trong những kim loại kiềm thổ nằm trong nhóm 2 của bảng tuần hoàn. Nó được biết đến với tính chất hoạt động mạnh, dễ phản ứng với nước, acid và không khí. Khi tiếp xúc với nước, Barium thường tạo ra barium hydroxide, một chất tan trong nước, và giải phóng khí hydro.1.2 Tính Chất Nước
Nước (H₂O) không chỉ là một dung môi phổ biến mà còn là một chất phản ứng quan trọng trong nhiều quá trình hóa học. Nước có khả năng hòa tan nhiều chất và tham gia vào các phản ứng hóa học khác nhau, đặc biệt là trong các phản ứng acid-base.
2. Phản Ứng Giữa Barium và Nước
2.1 Phương Trình Hóa Học
Khi Barium phản ứng với nước, phản ứng này có thể được biểu diễn bằng phương trình hóa học sau: \[ \text{Ba} + 2 \text{H}_2\text{O} \rightarrow \text{Ba(OH)}_2 + \text{H}_2 \uparrow \] Phương trình này cho thấy rằng một mol Barium phản ứng với hai mol nước để tạo ra một mol barium hydroxide và một mol khí hydro.2.2 Cân Bằng Phương Trình Hóa Học
Việc cân bằng phương trình hóa học là rất quan trọng trong hóa học. Để cân bằng phương trình trên, chúng ta cần đảm bảo rằng số lượng nguyên tử của mỗi nguyên tố ở bên trái và bên phải là bằng nhau. Trong trường hợp này, với một nguyên tử Ba và hai nguyên tử H từ nước, chúng ta cân bằng được phương trình.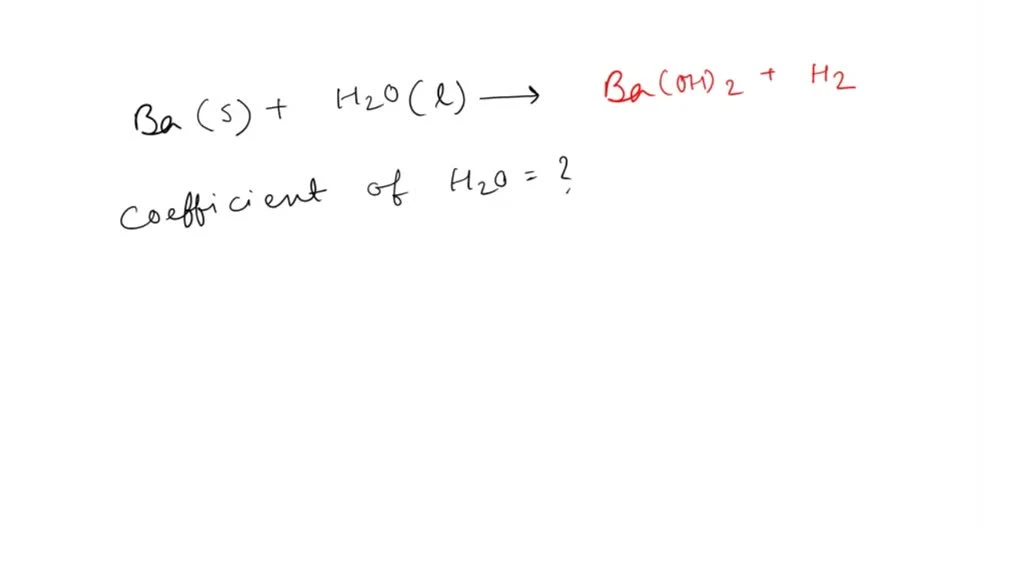
3. Cơ Chế Phản Ứng
3.1 Phản Ứng Thay Thế Đơn
Phản ứng giữa Barium và nước là một loại phản ứng thay thế đơn, trong đó Barium thay thế hydrogen trong nước. Do Barium có tính hoạt động cao hơn hydrogen, nó có khả năng phá vỡ liên kết hydrogen trong H₂O và tạo thành barium hydroxide và khí hydrogen.3.2 Sản Phẩm Tạo Thành
Sản phẩm của phản ứng này là barium hydroxide (Ba(OH)₂), một chất rắn tinh khiết, có màu trắng và tan trong nước. Nó được sử dụng trong nhiều ứng dụng như:- Sản xuất hóa chất: Barium hydroxide được sử dụng làm nguyên liệu trong sản xuất các sản phẩm hóa học khác.
- Nông nghiệp: Chất này có thể được sử dụng trong một số quy trình nông nghiệp để điều chỉnh độ pH của đất.

4. An Toàn Khi Làm Việc Với Barium và Nước
4.1 Tính Bất Ổn của Barium
Barium là một kim loại có thể gây ra nguy hiểm nếu không được xử lý đúng cách. Khi tiếp xúc với nước, phản ứng tạo ra khí hydrogen có thể dẫn đến sự hình thành các hỗn hợp nổ nếu có ngọn lửa gần đó. Do đó, việc làm việc với Barium và nước cần tuân thủ các quy tắc an toàn nghiêm ngặt.4.2 Hướng Dẫn An Toàn
- Sử dụng bảo hộ cá nhân: Đeo kính bảo hộ và găng tay khi làm việc với Barium và dung dịch barium hydroxide.
- Làm việc trong môi trường thông gió tốt: Đảm bảo nơi làm việc thông thoáng để tránh tích tụ khí hydrogen.
- Tránh tiếp xúc trực tiếp: Tránh để barium tiếp xúc với da và mắt.

Kết Luận
Phản ứng giữa Barium và nước là một minh chứng rõ ràng cho sự thú vị và kỳ diệu của hóa học. Từ việc tạo ra barium hydroxide cho đến khí hydrogen, mọi khía cạnh của phản ứng này đều đáng để khám phá. Chắc chắn rằng, việc hiểu rõ về những phản ứng này không chỉ giúp chúng ta nắm bắt kiến thức mà còn có thể áp dụng vào thực tiễn trong các lĩnh vực khác nhau. Hãy luôn nhớ kiểm tra các quy tắc an toàn và thực hành hóa học một cách có trách nhiệm. Với sự hiểu biết và kiến thức, chúng ta có thể tận dụng những phản ứng này để phục vụ cho cuộc sống hàng ngày và phát triển công nghệ trong tương lai.
Link nội dung: https://wru.edu.vn/tim-hieu-phan-ung-bah2o-trong-hoa-hoc-a14329.html