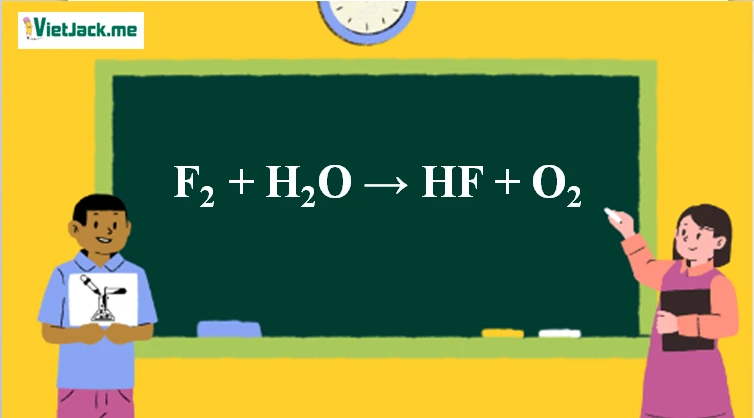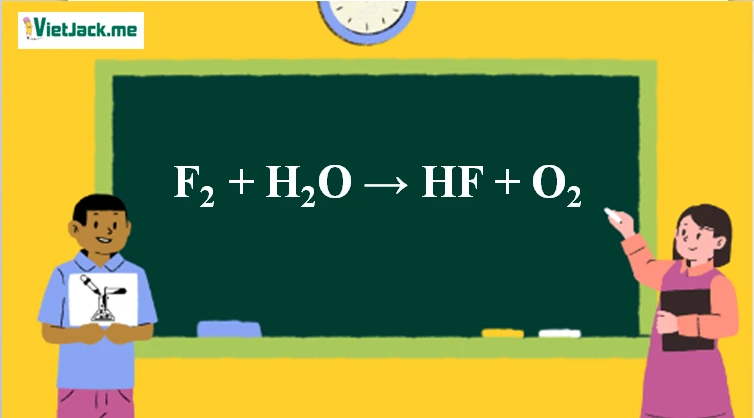
Giới thiệu về phản ứng F2 + H2O
Phản ứng giữa flo (F2) và nước (H2O) tạo ra axit hydrofluoric (HF) và oxi (O2) là một trong những phản ứng hóa học thú vị và đặc biệt quan trọng trong ngành hóa học. Sự tương tác này không chỉ giúp chúng ta hiểu rõ hơn về tính chất của flo mà còn mở ra nhiều ứng dụng trong thực tiễn. Trong bài viết này, chúng ta sẽ đi sâu vào từng khía cạnh của phản ứng này, từ điều kiện xảy ra cho đến ứng dụng và tính chất của các chất tham gia.
1. Phương trình phản ứng giữa Flo và H2O
Phương trình phản ứng giữa flo và nước được biểu diễn như sau:
F2 + H2O → HF + O2
Điều này có nghĩa là một phân tử flo phản ứng với một phân tử nước để tạo ra một phân tử axit hydrofluoric và một phân tử oxi. Đây là một phản ứng hóa học phức tạp và dễ gây nhầm lẫn nhưng lại rất thú vị trong nghiên cứu hóa học.
2. Điều kiện phản ứng xảy ra giữa Flo và H2O
Nhiệt độ thường
Phản ứng giữa flo và nước thường xảy ra ở nhiệt độ thường, nhưng để tạo ra hiệu ứng rõ ràng, cần phải có sự tác động của nhiệt độ. Khi đun nóng nước, phản ứng sẽ xảy ra mạnh mẽ hơn, tạo ra khí oxi và axit hydrofluoric.
3. Hiện tượng phản ứng xảy ra giữa F2 và H2O
Khi flo tiếp xúc với nước, đặc biệt là khi nước được đun nóng, sẽ xảy ra hiện tượng bốc cháy. Điều này là do sự giải phóng oxi từ phản ứng, khiến cho nước trở thành một chất bị bốc cháy trong điều kiện nhất định.
4. Bản chất của F2 (Flo) trong phản ứng
Flo là phi kim mạnh nhất trong bảng tuần hoàn và có tính oxi hóa mạnh. Điều này có nghĩa là nó có khả năng chiếm electron từ các chất khác một cách hiệu quả. Khi flo đi qua nước, nó làm bốc cháy nước do giải phóng khí oxi. Đây là lý do tại sao phản ứng này được coi là một trong những phản ứng hóa học mạnh mẽ và đặc biệt.
5. Mở rộng tính chất hóa học của Flo
5.1. Phản ứng với hidro
Flo cũng phản ứng rất mạnh mẽ với hidro, thường xảy ra ngay cả trong bóng tối và ở nhiệt độ rất thấp. Phản ứng này tạo ra hydrogen fluoride (HF):
F2 + H2 → 2HF
5.2. Phản ứng với các kim loại
Flo có khả năng oxy hóa tất cả các kim loại, bao gồm cả vàng (Au) và bạch kim (Pt). Phản ứng này tạo ra muối florua kim loại với bậc oxi hóa cao tương ứng với kim loại đó. Ví dụ:
3F2 + 2Au → AuF3
Đối với các kim loại kiềm và kiềm thổ, phản ứng sẽ diễn ra mạnh mẽ và có thể sinh ra nhiệt lượng lớn.
5.3. Phản ứng với các phi kim khác
Flo cũng có khả năng phản ứng với hầu hết các phi kim khác, ngoại trừ oxi, nito, neon, helium và argon, tạo ra các hợp chất công hóa trị. Ví dụ:
3F2 + S → SF6
Ngoài ra, flo cũng có thể phản ứng với các halogen khác trong điều kiện đặc biệt:
- F2 + Cl2 → 2ClF (điều kiện: 250°C)
- 3F2 + 2Au → AuF3 (điều kiện: nhiệt độ cao)
5.4. Phản ứng trao đổi
Flo có khả năng dời chỗ các halogen khác ra khỏi hợp chất ion hoặc hợp chất công hóa trị trong điều kiện xác định. Ví dụ:
F2 + 2KCl (rắn) → 2KF + Cl2 (điều kiện: lạnh)
5.5. Phản ứng với các hydrua
Flo cũng có thể phản ứng với nước khi được đun nóng, tạo ra axit hydrofluoric và oxi:
2F2 + H2O → 4HF + O2 (điều kiện: nhiệt độ cao)
Ngoài ra, với các hydrua khác như H2S và NH3, flo sẽ tạo ra HF cùng với các sản phẩm phụ khác.
5.6. Phản ứng với dung dịch kiềm
Khác với các halogen khác, flo không tạo ra muối chứa oxi. Khi phản ứng với kiềm loãng (như NaOH 2%) ở nhiệt độ thấp, flo tạo ra oxygen difluoride và florua:
2F2 + 2NaOH → 2NaF + OF2↑ + H2O (điều kiện: NaOH lạnh, 2%)
6. Ứng dụng của F2
Flo được sử dụng rộng rãi trong nhiều lĩnh vực khác nhau:
- Chất oxi hóa cho nhiên liệu lỏng: Flo thường được sử dụng làm chất oxi hóa trong các tên lửa.
- Điều chế dẫn xuất độc đáo: Flo được dùng để tạo ra một số hợp chất có tính chất độc đáo.
- Thuốc chống sâu răng: Dung dịch NaF loãng thường được sử dụng như một loại thuốc chống sâu răng hiệu quả.
- Công nghiệp sản xuất hạt nhân: Flo đóng vai trò quan trọng trong ngành công nghiệp sản xuất hạt nhân.
7. Tính chất hóa học của H2O
7.1. Nước tác dụng với kim loại
Ở điều kiện thường, nước có thể phản ứng với các kim loại mạnh như Li, Ca, Na, K, Ba,… để tạo thành dung dịch bazo và khí hidro. Ví dụ:
- 2Na + 2H2O → 2NaOH + H2
- Ca + 2H2O → Ca(OH)2 + H2
7.2. Nước tác dụng với oxit bazo
Nước có khả năng phản ứng với một số oxit bazo như Na2O, CaO, K2O,… để tạo thành dung dịch bazo tương ứng:
- Na2O + H2O → 2NaOH
- CaO + H2O → Ca(OH)2
7.3. Nước tác dụng với oxit axit
Khi nước tác dụng với oxit axit, nó tạo ra axit tương ứng. Dung dịch axit làm quỳ tím hóa đỏ:
- CO2 + H2O → H2CO3
- SO3 + H2O → H2SO4
8. Câu hỏi trắc nghiệm liên quan đến Flo
Chúng ta có thể kiểm tra kiến thức về flo qua một số câu hỏi trắc nghiệm thú vị. Dưới đây là một số câu hỏi tiêu biểu:
Câu 1: Dãy các đơn chất halogen nào sau đây được xếp theo thứ tự tính oxi hóa tăng dần?
A. F2, Cl2, Br2, I2
B. Cl2, Br2, I2, F2
C. Cl2, F2, Br2, I2
D. I2, Br2, Cl2, F2
Lời giải: A
Câu 2: Dãy các axit nào sau đây được xếp theo thứ tự tính axit giảm dần?
A. HCl, HBr, HI, HF
B. HI, HBr, HCl, HF
C. HBr, HI, HF, HCl
D. HF, HCl, HBr, HI
Lời giải: B
Câu 3: Phát biểu nào sau đây đúng?
A. Dung dịch NaF phản ứng với dung dịch AgNO3 sinh ra AgF kết tủa.
B. Iot có bán kính nguyên tử lớn hơn brom.
C. Axit HBr có tính axit yếu hơn axit HCl.
D. Flo có tính oxi hóa yếu hơn clo.
Lời giải: B
Kết luận
Phản ứng giữa flo và nước không chỉ đơn thuần là một phản ứng hóa học, mà còn là minh chứng cho tính chất đặc biệt của flo. Với tính oxi hóa mạnh mẽ, flo có thể tạo ra nhiều sản phẩm hóa học quan trọng, từ đó góp phần vào nhiều ứng dụng trong thực tiễn. Hi vọng bài viết này đã giúp bạn có cái nhìn sâu sắc hơn về phản ứng F2 + H2O và các tính chất hóa học liên quan. Hãy cùng khám phá thêm nhiều điều thú vị khác trong thế giới hóa học!