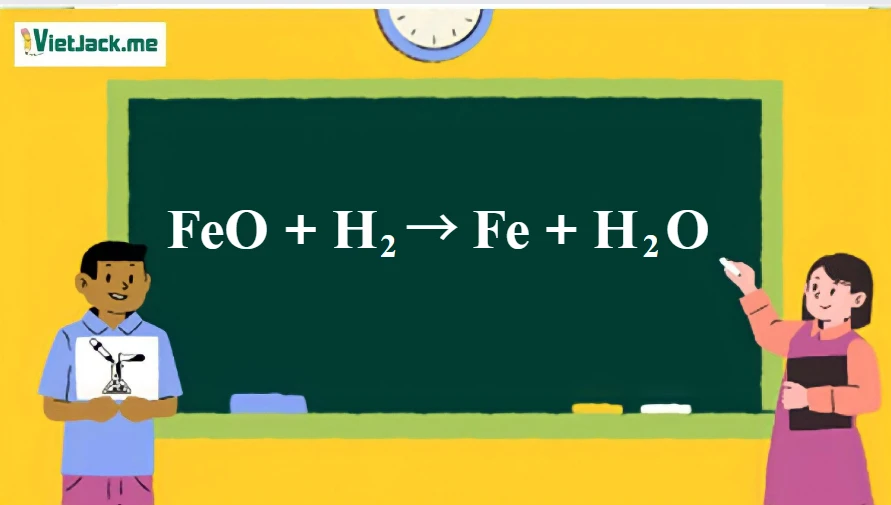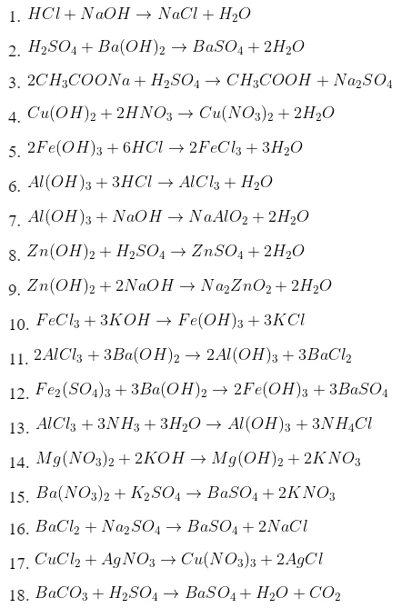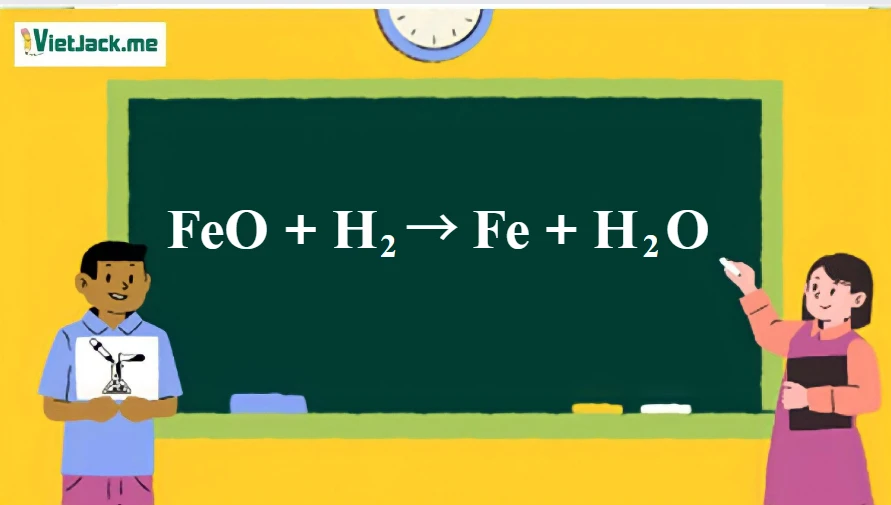
Giới thiệu tổng quan về phản ứng FeO + H2
Phản ứng giữa oxit sắt (FeO) và khí hydro (H2) là một trong những phản ứng hóa học quan trọng được ứng dụng rộng rãi trong ngành công nghiệp và nghiên cứu hóa học. Phản ứng này thể hiện sự biến đổi giữa các dạng oxit của sắt và kim loại sắt, đồng thời minh họa cho tính chất khử của hydrogen.
Phương trình phản ứng
Phương trình phản ứng chính được biểu diễn như sau:
FeO + H2 → Fe + H2O
Trong đó:
- FeO là oxit sắt (II) - chất tham gia phản ứng.
- H2 là khí hydro - chất khử.
- Fe là sắt nguyên chất - sản phẩm của phản ứng.
- H2O là nước - một sản phẩm phụ của phản ứng.
Điều kiện cần thiết cho phản ứng
Nhiệt độ
Phản ứng này thường diễn ra ở nhiệt độ cao để tăng cường tốc độ phản ứng. Nhiệt độ tối thiểu để bắt đầu phản ứng thường từ 300°C đến 800°C, tùy thuộc vào môi trường và điều kiện cụ thể.
Hiện tượng nhận biết phản ứng
Trong quá trình phản ứng, đặc điểm nhận biết dễ thấy là:
- Chất rắn màu đen của FeO sẽ dần chuyển sang màu trắng xám của kim loại sắt (Fe).
- Xuất hiện hơi nước và có thể thấy chất lỏng (nước) kết tụ.
Bản chất của các chất tham gia phản ứng
Bản chất của FeO
- FeO đóng vai trò là chất oxi hóa trong phản ứng này, cho thấy khả năng dễ dàng bị khử qua tương tác với hydrogen.
Bản chất của H2
- H2 hoạt động như chất khử, có khả năng cung cấp electron cho FeO, giúp chuyển đổi FeO thành sắt.
Tính chất hóa học của FeO
FeO không chỉ đơn thuần là một oxit mà còn mang trong mình những tính chất hóa học đa dạng:
Tính oxit bazo
FeO được xếp vào loại oxit bazo, có khả năng phản ứng với các dung dịch axit. Ví dụ:
FeO + 2HCl → FeCl2 + H2
FeO + H2SO4 → FeSO4 + H2O
Tính oxi hóa
FeO cũng biểu hiện tính oxi hóa khi phản ứng với các chất khử:
FeO + H2 → Fe + H2O
FeO + CO → Fe + CO2
Tính khử
Khi gặp các chất oxi hóa mạnh, FeO trở thành chất khử:
- Phản ứng với HNO3 (axit nitric):
3FeO + 10HNO3 → 3Fe(NO3)3 + NO + 5H2O
2FeO + 4H2SO4 → Fe2(SO4)3 + SO2 + 4H2O
Tính chất vật lý của FeO
- Màu sắc: FeO có màu xám hơi trắng.
- Đặc tính vật lý: Dễ rạn và dẻo, có khả năng dát mỏng hay kéo sợi.
- Khả năng dẫn điện: Mặc dù có khả năng dẫn điện và nhiệt nhưng không hiệu quả bằng nhôm hay đồng.
- Tính từ: Ở nhiệt độ cao (khoảng 800 độ C), FeO có khả năng nhiễm từ và sau đó sẽ mất từ tính.
Tính chất hóa học của H2
Tác dụng với oxi
Hydro phản ứng với oxi để tạo ra nước:
2H2 + O2 → 2H2O
Hỗn hợp khí hydrogen và oxi là hỗn hợp nổ, mạnh nhất khi tỉ lệ là 2:1.
Tác dụng với oxit kim loại
Hydro có khả năng phản ứng với nhiều oxit kim loại, như FeO, CuO, và Fe2O3. Ví dụ, phản ứng với CuO ở nhiệt độ 400°C:
H2 + CuO → Cu + H2O
Ứng dụng trong thực tế
Trong sản xuất sắt
Phản ứng FeO với H2 thường được áp dụng trong quá trình sản xuất sắt trong các lò cao hoặc lò điện. Phương pháp này giúp giảm thiểu sự ô nhiễm môi trường hơn so với các nhiên liệu hóa thạch truyền thống.
Trong nghiên cứu hóa học
Phản ứng này cung cấp cái nhìn sâu sắc về tính chất của oxit và các phản ứng khử, từ đó mở ra nhiều cơ hội nghiên cứu trong lĩnh vực vật liệu và hóa học phân tích.
Ví dụ minh họa
Để minh họa rõ hơn về phản ứng FeO và ứng dụng của nó trong hóa học, dưới đây là một số ví dụ phổ biến:
Ví dụ 1: Phân tích phản ứng
Câu hỏi: Trong các phản ứng sau, phản ứng nào không tạo ra muối sắt (II)?
A. Cho sắt tác dụng với dung dịch axit clohidric
B. Cho sắt tác dụng với dung dịch sắt(III)nitrat
C. Cho sắt tác dụng với dung dịch axit sunfuric
D. Cho sắt tác dụng với khí clo đun nóng
Giải đáp: Đáp án đúng là D. Phản ứng với khí clo sẽ tạo ra muối sắt(III) chứ không phải muối sắt(II).
Ví dụ 2: Phản ứng diễn ra
Câu hỏi: Phản ứng nào sau đây xảy ra?
A. Fe + CuSO4 → FeSO4 + Cu
B. Fe + ZnSO4 → FeSO4 + Zn
C. 2Fe + 3CuSO4 → Fe2(SO4)3 + 3Cu
D. 2Ag + Fe(NO3)2 → 2AgNO3 + Fe
Giải đáp: Đáp án đúng là A, vì kim loại sắt với hoạt động hóa học cao sẽ đẩy được đồng ra khỏi dung dịch.
Ví dụ 3: Kim loại và đồng sunfat
Câu hỏi: Cho các kim loại sau: Al; Zn ; Fe; Cu; Pb. Số kim loại tác dụng với dung dịch đồng sunfat là:
A. 1 B. 2 C. 3 D. 4
Giải đáp: Đáp án đúng là C, vì cả Al, Zn và Fe đều có khả năng tác dụng với CuSO4 để tạo ra sản phẩm mới.
Kết luận
Phản ứng giữa FeO và H2 không chỉ là một phần quan trọng trong lĩnh vực hóa học mà còn có ý nghĩa lớn trong công nghiệp. Việc nắm vững kiến thức này không những giúp hiểu rõ hơn về tính chất hóa học của các chất mà còn mở rộng khả năng áp dụng trong nhiều lĩnh vực khác nhau. Trên đây là một cái nhìn tổng quan về phản ứng FeO ra Fe và những thông tin thiết yếu xung quanh nó. Hy vọng rằng bạn đã có thêm nhiều kiến thức bổ ích từ bài viết này!