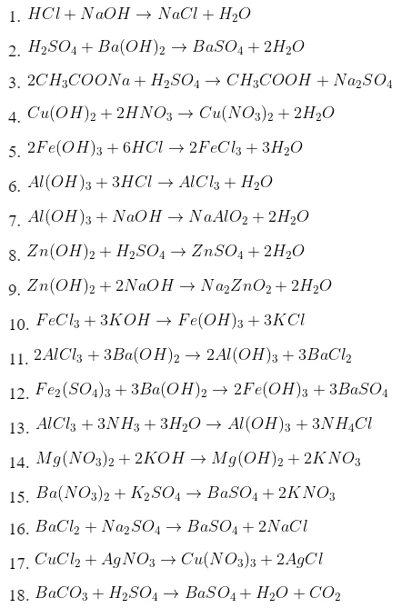Phản ứng hóa học giữa kim loại sắt (Fe) và axit clo-hydric (HCl) là một trong những phản ứng cơ bản trong hóa học vô cơ. Phản ứng này không chỉ tạo ra muối mà còn giải phóng khí hidro. Hãy cùng tìm hiểu chi tiết về phản ứng này, từ điều kiện, hiện tượng cho đến ứng dụng thực tiễn.

1. Phương trình phản ứng
Phương trình phản ứng giữa sắt và axit clohidric được biểu diễn như sau:
Fe + 2HCl → FeCl2 + H2
Trong đó:
- Fe là sắt
- HCl là axit clohidric
- FeCl2 là muối sắt(II) clorua
- H2 là khí hidro
2. Điều kiện phản ứng
2.1 Nhiệt độ
Phản ứng giữa sắt và HCl có thể diễn ra ở nhiệt độ thường. Đây là điểm nổi bật khiến phản ứng này tương đối dễ thực hiện trong phòng thí nghiệm.
2.2 Tình trạng của các chất
Sắt cần phải có dạng rắn (kim loại nguyên chất), trong khi dung dịch HCl thường được sử dụng là axit loãng.
3. Cách thực hiện phản ứng
Để tiến hành phản ứng, chúng ta có thể thực hiện theo các bước sau:
- Chuẩn bị dụng cụ: Ống nghiệm, kẹp ống nghiệm, đũa thủy tinh,…
- Cho một ít sắt vào đáy ống nghiệm.
- Thêm HCl: Nhỏ 1 - 2 ml dung dịch axit HCl vào ống nghiệm đã chứa sắt.
- Quan sát hiện tượng.
4. Hiện tượng sau phản ứng
Khi thực hiện phản ứng, bạn sẽ thấy:
- Kim loại sắt tan dần trong dung dịch axit HCl.
- Xuất hiện bọt khí không màu, đó chính là khí hidro (H2) được giải phóng.
5. Bản chất của các chất tham gia phản ứng
5.1 Bản chất của sắt (Fe)
- Chất khử: Trong phản ứng, Fe đóng vai trò là chất khử, có khả năng nhường điện tử.
- Tính khử: Sắt là kim loại có tính khử trung bình, có thể phản ứng với các axit mạnh nhưng sẽ bị thụ động hóa khi gặp HNO3 đặc nguội hoặc H2SO4 đặc nguội.
5.2 Bản chất của axit clohidric (HCl)
- Chất oxi hóa: HCl trong phản ứng đóng vai trò là chất oxi hóa, nhận electron từ Fe.
- Tác dụng với kim loại: HCl có khả năng tác dụng với nhiều kim loại đứng trước H trong dãy hoạt động hóa học, ngoại trừ chì (Pb).
6. Thông tin mở rộng về Fe
6.1 Tính chất vật lý
- Màu sắc: Sắt có màu trắng hơi xám.
- Đặc tính: Dẻo, dễ rèn, có độ dẫn điện và nhiệt kém hơn đồng và nhôm.
- Khối lượng riêng: 7,86 g/cm³.
6.2 Trạng thái tự nhiên
Sắt thường tồn tại ở dạng các hợp chất như oxit, sunfua và silicat. Quặng phổ biến bao gồm hematit (Fe2O3), manhetit (Fe3O4), và pirit (FeS2).
6.3 Tính chất hóa học
Tác dụng với phi kim
- Sắt phản ứng với oxi, tạo ra Fe3O4 sau phản ứng tổng hợp.
Tác dụng với dung dịch axit
- Fe + 2HCl → FeCl2 + H2
- Sắt không phản ứng với H2SO4 đặc nguội và HNO3 đặc nguội.
Tác dụng với dung dịch muối
- Sắt có khả năng đẩy kim loại yếu hơn ra khỏi muối. Ví dụ:
- Fe + CuSO4 → FeSO4 + Cu
6.4 Ứng dụng
Sắt đóng vai trò quan trọng trong nhiều lĩnh vực. Ví dụ:
- Trong gia đình: dao, kéo, đồ dùng.
- Trong xây dựng: khung cửa, cầu, tòa nhà.
- Trong giao thông: bộ khung cho xe cộ, thiết bị giao thông.
7. Tính chất hóa học của HCl
HCl là một axit mạnh, thể hiện nhiều tính chất hóa học quan trọng.
7.1 Tác dụng chất chỉ thị
- HCl làm quỳ tím đổi màu thành đỏ, một dấu hiệu nhận biết axit.
7.2 Tác dụng với kim loại
- Tất cả các kim loại đứng trước H sẽ phản ứng với HCl để tạo ra muối và khí hidro.
7.3 Tác dụng với oxit, bazo và bazo
- Sản phẩm tạo ra là muối và nước, chẳng hạn:
- NaOH + HCl → NaCl + H2O
7.4 Tác dụng với muối
- Theo điều kiện phản ứng trao đổi, HCl có thể tác dụng với các muối khác nhau.
8. Bài tập vận dụng liên quan
Để củng cố kiến thức về phản ứng giữa Fe và HCl, chúng ta có thể làm một số bài tập sau:
Câu hỏi 1
Kim loại Fe không phản ứng được với:
A. Dung dịch HCl
B. Dung dịch H2SO4 loãng
C. Dung dịch CuCl2
D. H2SO4 đặc, nguội
Lời giải: Câu đúng là D, vì Fe không phản ứng với H2SO4 đặc nguội.
Câu hỏi 2
Để nhận biết sự có mặt của Fe trong hỗn hợp gồm Fe và Ag, có thể dùng dung dịch nào?
A. HCl
B. AgNO3
C. H2SO4 đặc, nguội
D. NaOH
Lời giải: Câu đúng là A, dùng HCl sẽ làm Fe phản ứng và giải phóng khí H2.
Câu hỏi 3
Phát biểu nào sau đây sai?
A. NaCl được sử dụng làm muối ăn.
B. HCl tác dụng với sắt tạo ra muối sắt (III).
C. Axit HCl có tính oxi hóa và khử.
D. Nhỏ dung dịch AgNO3 vào dung dịch HCl, có kết tủa trắng.
Lời giải: Câu sai là B, vì HCl tác dụng với sắt chỉ tạo ra muối sắt (II).
Kết luận
Phản ứng giữa sắt và axit clohidric là một trong những phản ứng quan trọng và phổ biến trong hóa học. Việc hiểu rõ về phản ứng này không chỉ giúp nâng cao kiến thức hóa học mà còn có ứng dụng rộng rãi trong thực tế. Hy vọng bài viết đã cung cấp cho bạn những thông tin hữu ích và chi tiết nhất về phản ứng này.